BIOTECNOLOGÍA ROJA
¿Qué es la biotecnología roja?
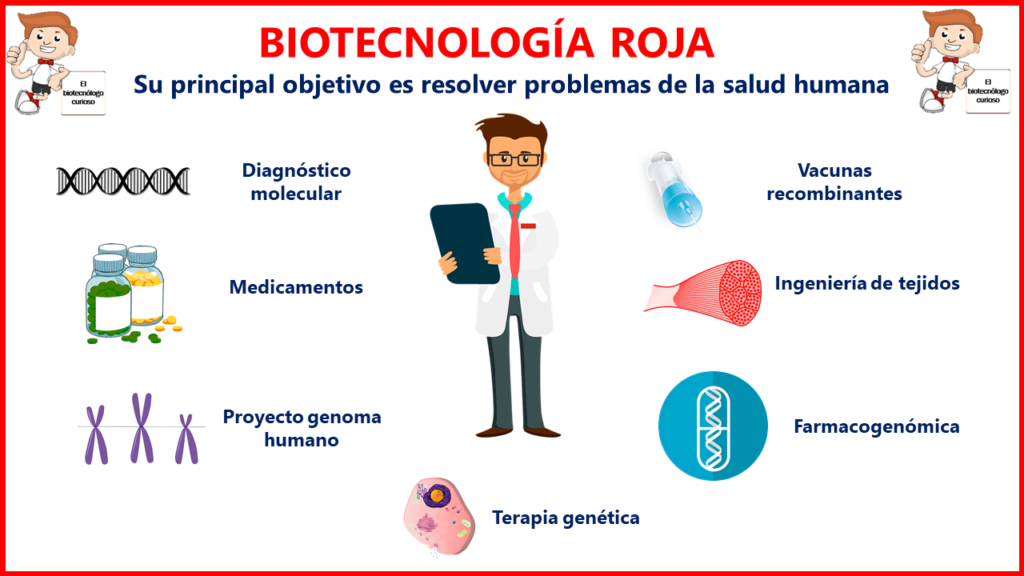
La biotecnología roja es una de las principales áreas de estudio alrededor del mundo y está enfocado en resolver problemas de la salud humana. Este campo de estudio utiliza sistemas vivos para influir positivamente en la calidad de vida de las personas, al ofrecer nuevos productos para el diagnóstico, prevención y tratamiento de enfermedades, así como la rehabilitación de los enfermos.
¿Cuáles son las aplicaciones de la biotecnología roja?
A continuación, se describen los principales ejemplos de la biotecnología medica:
Proteínas de interés terapéutico
En esta área de aplicación es donde se han obtenido los mayores logros a nivel mundial, ya que desde la aprobación en 1982 del primer producto biológico de uso terapéutico, la insulina humana, se han introducido al mercado una gran variedad de productos. Dentro de los productos recombinantes que actualmente existen en el mercado hay tratamientos para los siguientes padecimientos:
- Ataques cardiacos
- Embolias
- Cáncer de mama
- Esclerosis múltiple
- Deficiencia en la hormona de crecimiento humano
- Artritis reumatoide
- Enfermedad de Crohn
- Enfermedad de Gaucher
- Anemia asociada con fallas renales crónicas
- Hemofilia A
- Fibrosis quística
- Diabetes
La tendencia en esta área está dirigida principalmente a terapias en tres segmentos del mercado como se menciona a continuación:
Enfermedades infecciosas
- Terapia de inmunoglobulinas
- Choque séptico
- SIDA
Cáncer
- Colon
- Células sanguíneas
- Ovarios
- Pulmón
- Mama
- Melanoma
Problemas de adhesión celular
- Enfermedades autoinmunes
- Transplantes
- Alergias
- Coágulos sanguíneos
Vacunas
Entre los principales objetivos de este campo de estudio es ofrecer la posibilidad de desarrollar vacunas que no podrían producirse de otra manera, así como de mejorar las vacunas ya existentes, al hacerlas más seguras y más estables. A continuación, se mencionan las diferentes estrategias metodológicas para el desarrollo de vacunas.
- Síntesis de proteínas del patógeno
- Utilización de vectores virales o microbianos atenuados, como portadores de antígenos
- Vacunas de ácidos nucleicos (DNA y RNA)
- Producción de vacunas comestibles
- Atenuación de patógenos por métodos recombinantes.
Diagnóstico molecular
Las técnicas de diagnóstico modernas ofrecen alta especificidad, sensibilidad y rapidez, lo cual es esencial para detectar oportunamente las enfermedades (activas o latentes) y/o microorganismos, con el uso de anticuerpos monoclonales o con la hibridación de ácidos nucleicos.
Entre las principales aplicaciones de las pruebas de diagnóstico molecular se encuentran: Diagnóstico de patógenos y Diagnóstico genético. A continuación, se abordan las principales características de estás ramas.
Diagnóstico de patógenos
- La detección en números bajos del patógeno
- Desarrollo de herramientas para el diagnóstico, vigilancia, control y prevención de enfermedades de importancia en salud pública
- Estudio de mutaciones en genes asociados a resistencia a fármacos permite el diagnóstico oportuno de cepas resistentes
Diagnóstico genético
- Detección y predecir los desórdenes causados por defecto en un solo gene
- Desarrollo de métodos diagnósticos genéticos precisos, rápidos y económicos
- Desarrollo de métodos para el diagnóstico oportuno de neoplasias malignas en estadios iniciales
Diseño, producción y administración de fármacos
En este rubro están incluidas las sustancias terapéuticas no proteicas (la inmensa mayoría de los fármacos en uso). Dicho lo anterior, resulta importante la producción de moléculas con potencial farmacológico aplicadas a las principales causas de demanda médica (diabetes millitus, enfermedades cardiovasculares, hipertensión arterial, etc.).
Por tal motivo es necesario identificar nuevos blancos terapéuticos, así como para diseñar medicamentos de manera racional, que sean más efectivos y tengan menos efectos colaterales. Aunque la biotecnología roja ha influido de manera importante en los procesos de descubrimiento de fármaco, aún quedan los siguientes obstáculos:
- El número de proteínas-blanco potenciales es limitado
- Validación de la utilidad terapéutica de las mismas no es sencillo, debido a que se requiere un conocimiento detallado del proceso patofisiológico.
Proyecto genoma humano
Con la información generada de la secuenciación del genoma del humano, permite asociar los genes a las enfermedades y las vías metabólicas involucradas, lo que favorece al desarrollo de medicamentos. Además, permite aplicar todo este conocimiento a las ciencias forenses.
Medicina molecular y ciencia genómica
La medicina molecular tiene la capacidad de detectar y manipular genes responsables de enfermedades. Los primeros resultados en este campo se obtuvieron con el aislamiento de genes involucrados a algunas enfermedades monogénicas. Sin embargo, estos métodos no tienen la misma capacidad para encontrar los genes causantes de enfermedades familiares multigénicas.
Por tal motivo, la ciencia genómica permite la caracterización global y simultánea de la expresión y función de todos los genes (genoma) de un organismo en condiciones de salud y enfermedad, lo que genera nuevas oportunidades para descubrir con mayor facilidad los genes asociados a enfermedades monogénicas y desórdenes multigénicos.
A continuación se mencionan los principales beneficios de la ciencia genómica:
- Identificar los genes asociados a diferentes enfermedades hereditarias. Con la posibilidad de anticipar y prevenir padecimientos.
- Clasificar algunas enfermedades, con base en los perfiles de expresión global del genoma.
- Identificar nuevos blancos terapéuticos.
- Estudiar la variación polimórfica de diversos marcadores genéticos en diferentes individuos y grupos étnicos.
Con los avances obtenidos con la ciencia genómica y medicina molecular surgen dos áreas de estudio que es la Farmacogenómica y la terapia génica.
Farmacogenómica
Permite mejorar el diseño de medicamentos y la selección de tratamientos eficaces basadas en el perfil genético de cada paciente.
Terapia génica
Ofrece la posibilidad de corregir desórdenes genéticos heredados, enfermedades infecciosas o efectos colaterales tóxicos de las quimioterapias.
Liberación de medicamentos
Desarrollar nuevos transportadores de medicamentos a los sitios de acción específicos (células u órganos).
Ingeniería de tejidos
Es un área que estudia el crecimiento de nuevos tejidos y organismos in vitro. Cabe señalar que este campo combina células madre, biomateriales y señales para generar tejidos como huesos, cartílago, vasos sanguíneos, piel y músculo.
La biotecnología roja: economía y regulación
El efecto de la biotecnología en la salud se ve reflejada claramente en el lanzamiento de nuevos medicamentos biotecnológicos. Por tal motivo, se espera que dentro de 10 años la mitad de los nuevos medicamentos serán biotecnológicos o que se utilice por lo menos en alguna etapa de producción la biotecnología. Los biomedicamentos han tenido una importante repercusión en los costos totales de tratamiento de enfermedades, mejorar la calidad de vida del enfermo y disminuir la hospitalización o la incapacidad permanente.
Por estos beneficios, el mercado de productos farmacéuticos de uso humano provenientes de la biotecnología roja tuvo un valor superior a los 13,000 millones de dólares, con un crecimiento anual del 14%, lo que contrasta con el sector farmacéutico tradicional que sólo creció un 6%. Se espera que los biomedicamentos tengan un crecimiento del 12% anual durante los próximos años y que alcancen ventas por más de 200,000 millones de dólares para el año 2050.
Cabe mencionar que de todos los productos recombinantes existentes, sólo 7 constituyen el 70% del mercado total. A continuación se enumeran:
- Eritropoyetina.
- Hormona de crecimiento humano.
- Vacuna contra hepatitis B.
- Factor estimulador de colonias de granulocitos y macrófagos.
- Insulina.
- Interferón alfa.
- Factor activador del plasminógeno.
Sin embargo, el número de estos productos seguirá aumentando exponencialmente durante las siguientes décadas, por el conocimiento del genoma humano. Por tal motivo, la industria biofarmacéutica es una de las más estrictamente reguladas en el mundo. Cualquier producto que llega al mercado debe contar con la autorización de la institución reguladora local, lo cual se obtiene después de un largo proceso en el que se evalúan calidad, seguridad y eficacia.
Regulación internacional
Como se mencionó anteriormente, las instituciones reguladoras deben evaluar y aprobar nuevos medicamentos biotecnológicos. En términos generales, la legislación abarca cuatro áreas que se describen a continuación.
- Investigación y desarrollo de nuevos medicamentos.
- Pruebas preclínicas y clínicas.
- Manufactura de medicamentos.
- Comercialización de medicamentos.
